
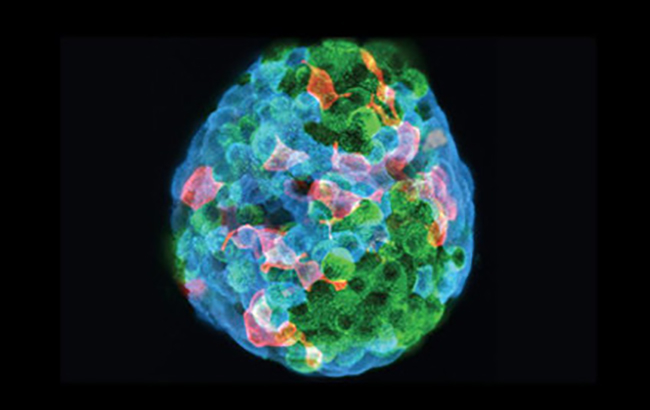
نشانگر Flattop، سلولهای بتای پانکراس را که انسولین تولیدمیکنند به ۲دسته تقسیممیکند: سلولهای حفظکنندهی متابولیسم گلوکز و سلولهای نابالغی که به دفعات بیشتر تقسیمشده و با تغییرات متابولیک سازگار میشوند. به گزارش دانشمندان دانشگاه فنی مونیخ (TUM)، این موضوع میتواند نقطهی شروعی برای درمانهای ترمیمی دیابت (Regenerative diabetes therapies) باشد. محققان نشانگرهای مولکولی را جستجوکردند که زیرگروههای گیرنده را به دستههای کوچکتر تقسیم میکنند و یک مولکول بهطورخاص، توجه آنها را بهخود جلبکرد: مولکول پروتئینی Flattop، که حدوداً در ۸۰ درصد از تمامی سلولهایبتا وجود دارد. این سلولها غلظت گلوکز در محیط پیرامون خود را بهگونهی مؤثری تعیینکرده و مقدار متناسبی انسولین ترشح میکنند و بنابراین ویژگیهای متابولیک سلولهای بتای بالغ را ازخود نشانمیدهند. برعکس، گروه محققان مشاهدهکردند که سلولهای بتایی که در آنها هیچ مقدار قابل اندازهگیری از مولکول Flattop موجود نیست، باسرعت قابلتوجهی تکثیر میشوند. در الگوی آزمایشی، تکثیر این سلولها تا ۴برابر بیشتر از سلولهای Flattop مثبت بود. بهمنظور پیگیری این فرض که سلولهایی که فعالانه تقسیممیشوند (سلولهای فاقد مولکول Flattop) میتوانند پیشسازهای(Precursor) سلولهایی باشند که فعالیت متابولیک بالایی دارند، دانشمندان از یک ترفند ژنتیکی برای نقشهبرداری از سرنوشت سلولهای منفرد استفادهکردند. این شیوه که اصطلاحاً «ردیابی دودمان سلولی» (Lineage tracing) نامیدهمیشود، آشکارکرد که سلولهای مولد تکثیرشونده (Proliferative progenitor cells) قادرهستند تا بهصورت سلولهای بتای بالغی که ویژگیهای متابولیک دارند، تکامل پیداکنند. زمانیکه دانشمنــدان آنها را در یک محیــط سهبعدی مصنوعی شبه ارگان (Mini-organ-like 3D environment) قراردادند، بازهم همین وضعیت برقرار بود. علاوه بر این، طی تجزیه و تحلیلهای ژنتیک این موضوع تأییدشد که در سلولهای بتای فاقد Flattop، اساساً ژنهایی بیان میشوند که عامل حس محیط هستند، درحالیکه در سلولهای دارای مولکولFlattop اغلب برنامههای متابولیک کلاسیک اجرامیشوند. یافتههای ما بیانگر آن هستند که سلولهای Flattop منفی، نوعی مخزن ذخیرهیسلولهای نابالغ (Immature reserve pool) هستند که دائماً خود را تجدید میکنند و میتوانند ذخیرهی تازهای برای سلولهای بتای بالغ فراهمکنند. این امکان جدید برای تفکیک ۲زیرگروه یادشده، انجام تحلیل جامعی از مسیرهای سیگنالدهی (Signaling pathways) مرتبط با این روند را امکانپذیر میسازد. یافتههای محققان امیدهایی برای ایجاد و توسعهی درمانهای ترمیمی فراهممیکند؛ بیشاز ۵۰سال است که درمورد ناهمگنبودن سلولهایبتا بررسی و تحقیقشده است. اکنون بهنظرمیرسد که به کمک فنآوریهای پیشرفته، بهتدریج خواهیم توانست تا گونهی رفتار این سلولها را درککنیم.
Ref: Technische Universität München News July 15, 2016


ثبت نظر