
شماره ۱۲۱۶
پیشرفتهای نوین در درمان ملانوم بدخیم
پزشکی امروز
بیشاز دو دهه است که یکیاز مهمترین محورهای موردعلاقهام، در زمینه پژوهش پیرامون عوامل خطر و کارسینوژنها در ایجاد سرطانهایپوست بودهاست. یکیاز اولین بررسیها دراینزمینه در ایران، بررسیهای ما درمورد نقش موتاسیونP53 در ایجاد سرطانهایپوست بود که چندین مقاله ازاین پژوهشها منتشرشد و همواره پیگیر پژوهشهای جدید دراینزمینه بودهام.
این بررسی با هدف ارایه از پیشرفتهای جاری در تحقیقات و پژوهشهای مرتبط با درمانهای نوین ملانوم و ارتباط بالینی آنها میباشد.
تا همین اواخر ملانوم بهعنوان یکبیماری غیرقابلدرمان شناختهمیشد.
بااینحال، درسالهایاخیر پیشرفتهای بسیار چشمگیری در درمان انواع آن بهوجودآمدهاست.
این امر بهدلیل دانش و درک عمیق ما از مسیرهای مولکولی درگیر در ایجاد، توسعه و متاستاز ملانوم است. اگرچه اهداف جدید همواره درحالظهور و تکوین هستند، ولی درک چگونگی غلبهبر مقاومت برای درمانهایجاری، امری بسیارمهم میباشد.
یکیاز جدیدترین مباحث درمورد درمانهاینوین ملانوم، درمانهای هدفمند براساس ژنتیک مولکولی است.
مقدمه:
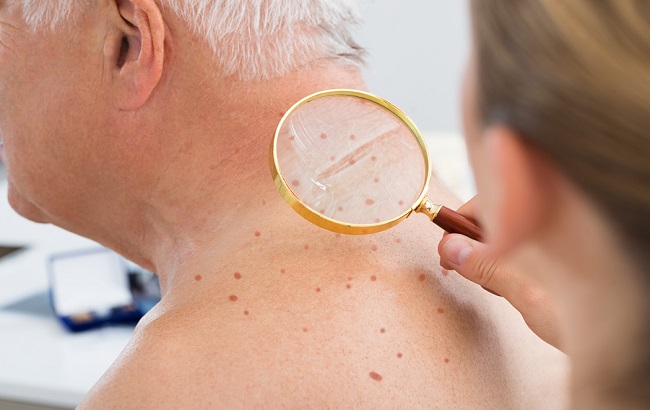
ملانوم بدخیم بهعنوان کشندهترین تومورپوست شناخته شدهاست و نزدیک به۴۸۰۰۰ مورد مرگومیر ناشیاز ملانوم درهرسال درسراسر جهان رخمیدهد. ملانوم شایعترین عوامل اصلی مرگ ناشیاز سرطان در زنان ۲۵تا۳۰سال است و هرساله درجهان برشیوع آن افزودهمیشود. بهعنوانمثال آمریکا در چند دهة گذشته شاهد افزایش چشمگیر موارد ملانوم بوده و میزان بروز آن ازسال۱۹۷۳ تاکنون بیشاز دوبرابر شدهاست.
بحث:
دریک پژوهشجدید، اخیراً ازکل توالیژنوم زیرمجموعههای انواع ملانومپوستی، آکرال و مخاطی، تعدادی از ژنهایمهم جهشیافته مشخصشدهاند.
این ژنها شامل N2A و NRAS و TP53 در ملانومپوستی، BRAF،NRAF وNF1 درملانوم آکرال وSF3B1 در ملانوممخاطی هستند. بررسی زیر بر مسیرهایی که در تولیدملانوم شرکتدارند، تغییرات ژنتیکی شناختهشده که در ملانوم رخمیدهند، درمانهای هدفمند که از استراتژیها گرفتهمیشود تا بهصورت درمانی ازاین تغییرات استفادهکنند و روشهای جدید مبتنیبر ایمنی در درمان ملانوم تمرکزنموده است. مسیرها و درمانهای موردبحث در این بررسی در جدول۱ خلاصه شدهاست.
BRAF و NRAF:
فعالشدن جهشها درBRAF شایعترین تغییراتژنتیکی در ملانوم هستند که شاید فقط بهوسیله جهش پیشبرنده Tert اتفاق افتاده باشند. تقریباً۵۰درصداز تمامی انواع کلینیکی ملانومها دارای جهش درBRAF هستند. بیشترین شیوع جهش در واکنش تبدیل والین به گلوتامیکاسید در کدون۶۰۰ است که V600E)BRAF) نامیدهشده و درمیان حدود۵۰درصداز ملانومها مشاهدهگردیده است. این میزان جهش در ملانوم بیشتراز سایر سرطانها است که V600E)BRAF) را به هستة اصلی در تولید ملانوم تبدیلمیکند و در بررسی که توسطTSAO و Maldonado انجامگشته، گزارششدهاست. جهشهای۲۱BRAFو۲۲ در ملانومهایی که درپوست درمعرض اشعه یووی ایجاد میگردند، بیشتر هستند و در ملانومهای آکرال و مخاطی کمتر مشاهدهمیشوند. این دادهها ممکناست نشاندهندکه BRAF توسط اشعه ماورایبنفش ایجادمیشود. بااینحال، انتقالT بهA که والین را در اسیدآمینه 600(BRAF(V600E به گلوتامیک اسید تبدیلمیکند، یک اثرجهشی کلاسیک توسط اشعهUV نیست. علاوهبر این جهشهایBRAF در ملانوم ایجادشده به وسیله اشعهUV حضور ندارند. بنابراین، جهش در (BRAF(V600E ممکناست درنتیجه یک اثر ثانویه آسیب از اشعهUV باشد. مانند تولید گونههایی از اکسیژن واکنشی یا یک جهش غیرکلاسیک درDNA که توسط اشعهUV ایجادمیشود. جهشهایBRAF بهتنهایی سبب ایجاد ملانوم نمیگردند و چندین پروتئین نشاندادهشدهاند که همراهبا BRAF موجب ایجاد سرطان میشوند. نشانداده شدهاست که عاملرونویسی مرتبط با(MITF) موجب ایجاد ملانوم میگردد. در ماهی راهراه، درترکیب با (BRAF(V600E، موتاسیونP53 برای ایجاد ملانومبدخیم کافی بود، درحالیکه در بررسی ما که یکیاز اولین بررسیها دراینزمینه درایران بود، موتاسیونP53 نقشی در ایجاد ملانوم نداشت بلکه بهعنوان عامل خطر در سرطانهای بدون ملانوما شناختهشد. براساس بررسی ما و سایر بررسیهای بعدی بهنظرمیرسد که موتاسیونP53 نقشی کلیدی در ایجاد ملانوم نداشتهباشد و همچنین بررسیهای گوناگون از نقش آن بهعنوان آنکوژن پیشبرنده یادمیکنند نه آغازکننده. بهعبارتدیگر نقشی در ایجاد ملانوم ندارد اما در گسترشتومور یا متاستاز آن میتواند دخیلباشد.
(BRAF(V600E دراصلMEK را که تنها هدف پاییندست شناختهشده BRAF است، به شیوه مستقلازRAS فعال میکند. برای مهارBRAF V600E چندین مهارکننده ایجاد شده است. (VEMURAFENIB(Zelboraf اولین مهارکننده بود که توسط سازمان غذا و داروی آمریکا(FDA) درسال۲۰۱۱ تاییدشد. دومین مهارکننده بانام (DABRAFENIB(Tafinlar درماه می سال۲۰۱۳ تاییدشد.ENCORAFENIB که بانامLGX818 نیز شناخته میشود، از جدیدترین درمانهای ملانوم میباشد.DABRAFENIB پاسخهای بالینی را در ۵۹درصداز بیماران باجهش درV600E/K نشانداد؛ شامل۷درصد پاسخگویی کامل. بهرغم موفقیت نخستین مهارکنندههایBRAF جهشیافته، بیماری بیشتر بیماران درنهایت با مقاومت به دارو عود میکند. این امر بهاحتمال زیاد بهدلیل تحریک پارادوکسیک سیگنالینگMEK-ERK در سلولحاوی ملانوم نوع BRAF و حاوی فعالکنندههایUpstream مربوط به مسیرERK بوده و موضوع بسیاریاز بررسیها میباشد. مهارکنندههای جدید مانندPLX7904 وPLX8394 درحالتوسعه هستند تا با مهارکردن مسیرERK در سلولهای دارایBRAF جهشیافته، بدون فعالکردنERK در سلولهای دارایBRAF دستنخورده براین پارادوکس غلبهکنند. ترکیبات حاوی مهارکنندههایMEK همراه با یک مهارکنندة BRAF نشان داده است که از درمان با یک مهارکنندة BRAF بهتنهایی مؤثرتر و کمتر توکسیک میباشد(احتمالاً بهعلت پیشگیریاز فعالشدن مسیر پارادوکسیکERA).
این رویکرد، روش درمان استاندارد برای بیماران مبتلا به ملانوم از نوعBRAF جهش یافته شدهاست. Trametinib اولین مهارکننده Mek بود که برای درمان ملانوم متاستاتیک با BRAF جهشیافته که قبلاً با مهارکنندههایBRAF مهار نشدهبود، تاییدگردید و همچنین در ترکیب با نوعDABRAFENIB مهارکننده BRAF تایید شدهاست. یکیدیگر از مهارکنندههای (Cobimetinib(MEK برای درمان ملانوم متاستاتیک با BRAF جهشیافته درترکیب بانوع VEMURAFENIB مهارکننده BRAF تایید شدهاست. درحال حاضر، ترکیبی از نوع BINIMETINIB مهارکننده MEK بانوع ENCORAFENIB مهارکننده BRAF در درمان ملانوم پیشنهاد شدهاست (همانطور که توسعه گریمالدی بررسی شدهاست). اخیراً مهارکنندههای خاصERK که اثرات بهتر و طولانیتری از آنها مورد انتظار است، مورد تایید قرارگرفتهاند مانند SCH772984، LTT462 و VTX11E.
NRAS، یک GTPASE است که موجب تولید دیمرهای یکسان و غیریکسان از BRAF وCRAF گشته و به فسفریلاسیون و فعالسازیMEK منجر میشود. اینGTPASE تقریباً عامل۲۰درصد از ملانومهای جهش یافتهاست. جهشهایNRASو BRAF تقریباً همیشه بهصورت متقابل منحصر بهفرد هستند. اگرچه اهداف مستقیم NRAS موفق نبوده است، اهداف پاییندست از NRAS مانندMEK درحالحاضر با موفقیت مهار شدهاند، هرچند که اثربخشی آنها برای ملانومهای جهشیافتة NRAS کمتر از مقدار مشاهدهشده در ترکیب با مهارکننده BRAF در ملانوم جهشیافتةBRAF میباشد.
MITF، یک Regulator اصلی ملانوسیتی و یک آنکوژن بقای نسل است که در۲۰درصداز موارد ملانوم تقویتمیشود. تقویتMITF با بقای۵ساله ضعیف همراه است. تجزیهوتحلیل عملکردی نشانداد که این جهش حذفی در کدون۳۱۸ موجب لغو تنظیم نگهدارنده منفی در سایت تعدیل پروتئینSUMO میشود. بنابراین سبب بیشفعالی رونویسی چند هدف MITF میگردد. اهداف مشخصیازMITF، پیشرفت چرخه سلولی و زندهماندن سلول را موجب میگردد.
ML329 به نظرمیرسد که بیانMITF را از طریق مکانیزمهای نامعلومی متوقفمیکند. رویکردهای درمانی درحال حاضر بر مهار ژنهای هدف آن و یا مدولاتورهای تقویتکننده تمرکز میکنند (همانطورکه توسط شتیلمن بررسی شد). از جمله ژنهای مهم و قابلتوجه که بهطورمستقیم توسط فعالیتهای رونویسیMITF تنظیم میشوند، تمام خانواده عواملی که سنتز، بلوغ، بستهبندی و ترانسفر رنگدانههای ملانین را انجام میدهند وجوددارند. بههمین دلیل MITFبهعنوان «تنظیمکنندة اصلی توسعه ملانوسیت» شناخته شدهاست، زیرا درموقعیت محوری در وسط عناصر سازنده قرارمیگیرد، مانند تمایز (در اثر اشعهuv) سازگار ملانوسیت و رنگدانهایشدن.

مابقی گونههای MITF که ممکناست به فعالیتهای آنکوژنیک کمککنند، شاملcdk2، یک تنظیمکننده چرخه سلولی؛ فاکتور 1ـ آلفای قابلتاثیر توسط هیپوکسی که برای بقا، آنژیوژنز و متاستاز در ملانوم ضروری است؛bcl2 و bcl2a1، یک عضو پروتئینی دارای اصل خاص و ضدآپوپتوزی مربوط به خانواده bcl2 که در ملانومهای با MITF زیاد تقویتشده و بیشازحد بیانمیگردد. سایر اهداف بالقوه که بیان MITF را تعدیلمیکنند شامل موارد زیر هستند:
۱)tyro3، یک گیرنده تیروزین کینازی که MITF را به روش وابسته به sox-10 تعدیلمیکند. ldc126، یک مهارکنندة tyro3/axl/mertk، که درمرحلة Pre clinical قرار دارد.
۲)پروتئاز اختصاصی یوبیکوئیتین(usp13)که برای جداسازی یوبیکوئیتین از MITF و تثبیت مهم است. اسپوتینـ1، یک مهارکننده برایusp10 و usp13 که در مرحلة pre clinical قرار دارد.
۳)مهارکنندههای هیستوندیاستیلاز(HDAC)، توانایی بازکردن کروماتین و تاثیر مثبت یا منفی بر بیان ژن دارند. نشاندادهشدهاست که مهار HDAC میتواند بیان را درهردوشرایطIn vitro وIn vivo سرکوبکند. یک کارآزمایی بالینی با پانوبینواستات (lbh589)، یک مهارکننده HDAC، در بیماران حاوی ملانوم متاستاتیک تکمیلشدهاست، اما در دوز مورد آزمایش اثربخش نیست. علاوهبراین، MITF در مقاومت دربرابر مهارBRAF نقشدارد. BRAF بهطورمستقیم کینازهای دو خاصیتیmek1 و mek2 را فسفریله میکند که آنها نیز به نوبة خود پروتئین کیناز فعالشده با میتوژن(erk1/2) را فسفریله و فعال میکنند. در میان اثرات آنها، erk1/2 موجب فعالشدنMITF شده و منجربه تخریب آن میگردد. تخریبMITF توسط مهارکنندههای BRAF مهارشده است. بنابراین، سطح بالایی ازMITF باعث رونویسی ژنهای هدف آن میشود. جالبتوجه است درمانملانوم BRAF جهشیافته با Vemurafenibسبب افزایش قابلتوجه دربیان مجموعة ژن چرخة اسیدسیتریک و همچنین چند فسفریلاسیون اکسیداتیو و مجموعههای ژن سنتز atp میگردد. علاوهبراین،MITF با خاصیت افزایش بیان ژنهای فسفریلاسیون اکسیداتیو شناخته شد. این تنظیم ژنهای فسفریلاسیون اکسیداتیو نتیجة القای مستقیم بیان آلفاـPGC1،(یک تنظیمکننده اصلی میتوکندری) توسط MITF هستند. بنابراین ترکیبی از یک مهارکنندة BRAF با یک مهارکنندة میتوکندریایی ممکناست برای غلبهبر مقاومت برای مهارBRAF مفید باشد.
واربورگ زیستشناس برنده جایزه نوبل پیشنهادمیکند که سلولهای سرطانی دارای میزان بالایی از گلیکولیز درمقایسه با متابولیسم اکسیداتیو حتی در شرایط اکسیژن بالا هستند. بهرغم تاکید بر گلیکولیز در متابولیسم سرطانهای گوناگون ازجمله لوکمیها، سرطانپروستات و سرطانپستان و همچنین ملانوم، برای رشد خود به فسفریلاسیون اکسیداتیو نیازمند هستند. درحقیقت، بعضیاز انواع ملانومها بهمیزان قابلتوجهی مصرف اکسیژن بیشتراز ملانوسیتها دارند. اخیراً هم MITF و همERK در میتوکندری یافتشدهاند. البته نقش آنها درمورد میتوکندری در ملانوسیتها یا ملانوم و اثرات آن (اگر وجود داشته باشد) بر عملکرد میتوکندریایی ملانوسیت و رشد ملانوم هنوز مشخص نشدهاست.
ازطرفدیگر خطر فامیلیالملانوما موردبحث بوده و گزارش شدهاست که ملانوما میتواند در فامیل شایع باشد. اگرچه شیوع انتقال ژنتیکی خطر ملانوما بهسادگی تعییننمیشود اما برخیاز عوامل مانند رنگ پوستومو در آن نقش بازی میکنند. برایمثال افرادیکه پوست روشن و مویبلوند دارند متغیرهای ژنتیکیMC1R خطر ملانوما را بالامیبرند که بهطور مثال در انسانهایی با الگوهای مشخص پیگمنتاسیون دیدهمیشود. بااینوجود آنالیز ارتباطی روی خانوادههای دارای ملانوما بهطورضمنی به مکان ژنتیکی بالقوهای تعلق دارد که دقیقاً لوکوس این ژن مشخص شدهاست که روی بازوی کوتاه کروموزوم21 قراردارد.
دراینمکان ژنتیکیCDKN2A (سابقاً بانامp16) یک گزینه قوی بود. بهایندلیل که نشاندادهشده محصول این ژنCDK4 را تنظیممیکند، بنابراین موجب توقف چرخه سلولی میگردد. متعاقباً بسیاری از جهشهایCDKN2A کشف شدهاند که با مسیرهای متفاوت در ایجاد سرطانسلولی نقش دارند و CDK2A را بهعنوان یک نشانگر بزرگ برای غیرفعالنمودن چرخه سلولی نشانمیدهد. فقدانCDK2A در ۱۶الی۴۱درصد از ملانومای غیرفامیلی رخمیدهد و در ملانوماهای فامیلیال نیز شایع است. مکان CDK2A دوپروتئین مشخص را کدگذاریمیکند که درطول تکهتکهشدن متناوب بهدستمیآیند؛ P16INK4a و P14ARF که هردوی آنها سرکوبکننده تومور هستند. P53، P14ARF را درطول مهارکردن بزرگترین تنظیمکننده منفی خود یعنیMDM2 فعالمیکند. P16INK4a پروتئین همراه با رتینوبلاستوما را فعالمیکند که برای انتقالG1-S و بازگرداندن آن به درون چرخه سلولی ازطریق بازخورد منفیCDK4 نقشدارد.
بنابراین فقدان P16INK4a و P14ARF مسیرهایRB وP53 را حذفمیکند.
اگرچه غیرفعالشدن مسیرP53 بهنظر میرسد که نشان از سرطانهای متعدد دارد، ولی جهشهایP53 فقط در۱۹درصداز تومورهای ملانوما یافت شدهاند که پیشنهاد میدهند برای غیرفعالسازیP53 مسیرهای دیگری نیز وجود دارند. علاوهبرP14ARFکه در بالا بحثشد، بیشازحد بیانشدنMDM2 و زیادشدنMDM4 در ملانوما یافتمیشود. علاوهبراینها افزایش بیانشدن و نقش ضدآپوپتوزی پروتئینP63 که با P53 مرتبط است در ملانوما کشفشد.
ازآنجاییکه P53 بهطورنادری در ملانوما جهش پیدامیکند اما بهطورعملی بهوسیله بیشاز حد بیانشدنMDM2 مهار میگردد، تجدید عملکردP53 بهوسیله عملکرد مهاریMDM2 ممکناست، یک رویکرد درمانی هدفمند و مناسب برای ملانوما باشد.ایدوسانتولین که آنتاگونیست خانوادهMDM2 است، هماکنون بهعنوان درمان جدید ملانوما تحتبررسی میباشد.
نتیجهگیری:
گلهای زیبای بهاری، رویاهای زمستانی ما هستند.
جبران خلیلجبران
امروزه با کشف روشهای درمانی نوین مانند درمان هدفمند برپایه ژنتیک مولکولی، بسیاریاز بیماریهای نظیر ملانوم متاستاتیک که درگذشتهای نهچندان دور درمانناپذیر و سرکش بودهاند، قابلدرمان شدهاند و این امر بهدلیل دانش و درک عمیق ما از مسیرهای مولکولی درگیر درایجاد، توسعه و متاستاز ملانوم است.
بدونشک تلاش، اراده وکوشش بیپایان دانشمندانی که چندیندهه از بهترین سالهای عمر گرانبهای خود را در این زمینه نثار این امر خطیر نمودهاند را نمیتوان نادیدهگرفت. درود بر روانپاک عزیزانیکه در این مسیر خدمت و جانفشانی نموده و مسیری را پیش روی ما نهادهاند که افق روشن آن از هماکنون هویدا میباشد.
یاد وخاطره آنان گرامیباد











ثبت نظر